El cuerpo humano está constituido por nichos microbianos, dentro de los cuales se encuentran especímenes que se encuentran en una condición de estabilidad, caracterizada por la diversidad de géneros que se relacionan entre si y con el hábitat, de modo tal que, tanto el hospedador como sus huéspedes se ven favorecidos por la interacción normal de microorganismos, dicho intervalo es conocido como eubiosis, al contrario, el término disbiosis, se define como un desequilibrio, reconocido por cambios en la composición y función de la microbiota. Por ello, la presente investigación tiene como objetivo establecer el rol de los bióticos en la eubiosis de la microbiota bucal, para de esta manera alcanzar los diferentes efectos y beneficios de los prebióticos en los mismos. Se efectuó la búsqueda de artículos y revisiones en los últimos 7 años en idiomas como el español, inglés y catalán, a través de las plataformas: Web Of Science, PubMed, Scholar Google, Phind, Refseek y Scielo, finalmente se encontraron 110 artículos, siendo seleccionados 70 disponibles como Free-Full-Text. concluyendo que los bióticos son una excelente vía terapéutica para producir agentes antimicrobianos, generando reducción y tratamiento de enfermedades, degradación de toxinas, e inclusive optimizar al sistema inmunológico a través del uso de las defensinas y producción de óxido nítrico (NO), reconociendo por parte del campo odontológico a los bióticos como una alternativa útil para reducir de una manera significativa las enfermedades que afectan a la microbiota.
Palabras clave: prebióticos, probióticos, microbiota, eubiosis y disbiosis. (fuente: DeCS BIREME)
The human body is composed of microbial niches, within which beings live in a state of balance, characterized by the abundance of species they have in relation to the host. This interaction between microorganisms and the host is known as eubiosis. On the other hand, disbiosis refers to an imbalance recognized by changes in the composition and function of the microbiota. The objective of this research is to establish the role of biotics in the eubiosis of the oral microbiota, in order to achieve different effects and benefits of prebiotics. A search for articles and reviews in the last 7 years was conducted in Spanish, English, and Catalan languages using various platforms as: Web of Science, PubMed, Scholar Google, Phind, Refseek and Scielo. A total of 110 articles were found, with 70 selected as Free-Full-Text. The conclusion is that biotics are an excellent therapeutic approach for producing antimicrobial agents, reducing and treating diseases, degrading toxins, and optimizing the immune system through the use of defensins and nitric oxide (NO). The dental field recognizes biotics as a useful alternative for significantly reducing diseases that affect the microbiota.
Key words: prebiotics, probiotics, microbiota, eubiosis, dysbiosis source: MeSH NLM)
Autor de correspondencia:
María Cristina Aguilera Monroy. [email protected]
Dirección: La Granja. Naguanagua Edo. Carabobo Venezuela.
ORCID: 0000-0002-9232-8286
El término Biotico proviene del latín tardío biotĭcus 'de la vida ordinaria', y este del griego, βιωτικόςbiōtikós 'de los seres vivos', 'de la vida', por tanto, es un adjetivo que hace referencia a todo aquello característico de los seres vivos o que se refiere a ellos1. Por tanto enmarcar los términos, probióticos, prebióticos y simbióticos bajo el adjetivo biótico es pertinente en este caso, en primera instancia, los probióticos son considerados microorganismos saprófitos o comensales de naturaleza acidófila por lo que no son afectados por secreciones corporales a bajo pH; se desarrollan fácilmente en diferentes nichos corporales y gracias a relaciones antagónicas o de competencia, impiden la adhesión y colonización de microorganismos perjudiciales, por lo que tienen una importante actividad antibacteriana, originando efectos beneficiosos para la salud en administraciones adecuadas2.
Luego se encuentran los prebióticos, compuestos no digeribles, presentes en la dieta, que inducen en la función y desarrollo de la microbiota autóctona, repercutiendo saludablemente en la salud, por tanto, el prebiótico favorece la armonía de los microorgansimos en un nicho y auspicia la labor del probiótico3 y por último están los Simbióticos; productos que abarcan sustancias con propiedades de probióticos y prebióticos. De allí que estos “bióticos” sean considerados como una opción biotecnológica importante a nivel mundial ya que actúa a favor de la salud en general como también en la prevención de infecciones que puedan repercutir en la salud bucal, puesto que, el uso prologando de los mismos permite controlar la disminución del desarrollo de caries y patologías periodontales4.
Es importante recordar que todos los seres vivos son parte de ecosistemas complejos, donde existen interrelaciones estrechas que desencadenan efectos producto de la presencia, desarrollo y muerte de otros individuos; una muestra de ello es la teoría “Química parasitaria de las caries” propuesta por Miller en 1980; cuya finalidad era entender el origen de microorganismos presentes en la cavidad bucal, como también la capacidad que éstos tienen de metabolizar los carbohidratos y originar ácidos tan potentes como para desmineralizar los tejidos dentales5.
Ahora bien, considerando lo anteriormente expuesto, se presenta el concepto del microbioma humano, ecosistema constituido por el hombre y los microorganismos que en él conviven, muchos de los cuales son microorganismos esenciales para mantener la salud, ya que junto con el sistema inmunológico resguardan frente a patógenos invasores evitando enfermedades6.
Asimismo, los nichos microbianos existen en armonía, constituidos por la riqueza de ejemplares que poseen en relación con el hospedador, por lo que tanto ambos se ven favorecidos por la interacción normal de microorganismos, dicho intervalo es conocido como “eubiosis”, al contrario, el término “disbiosis”, se define como un desequilibrio, reconocido por cambios en la composición y función de la microbiota7.
Es de interés conocer diferentes términos para el desenvolvimiento a lo largo de esta investigación, es por ello empezar a desglosar la expresión probiótico, propuesta por Lilli y Stillwell en 1965, que emana del griego “pro-vida” que sugiere a favor de la vida. Mientras que, en 1989, Fuller contempló a los probióticos como un suplemento alimenticio vivo, es decir, microorganismos que habitan en el tracto digestivo con la capacidad para emanar mecanismos de control para evitar el posible desarrollo de algunos cuerpos extraños, formando una barrera natural, cuya finalidad es defenderlos en contra de las infecciones8. Sin embargo, la descripción más exacta fue establecida por Teitelbaum y Walker, afirmando que los probióticos son una pluralidad que contiene microbios determinados y, que en relaciones convenientes puede afectar la microbiota intestinal, generando resultados provechosos hacia el huésped8. También, la Organización mundial de la Salud y La Organización de Alimentos y Agricultura de las Naciones Unidas (FAO) definen a los probióticos como “microorganismos provechosos para la salud del cuerpo humano, protegiendo y estimulando al sistema inmunológico”9. a la vez que se ha determinado su importante rol en las funciones digestivas, inmunitarias y respiratorias10.
No obstante, para poder considerar y utilizar a un microorganismo como probiótico es necesario básicamente que no sea patógeno ni tóxico, al igual que ha de ser libre de efectos adversos, renuente a la destrucción por secreciones gástricas y/o biliares, como también tener la facultad de adherirse al epitelio intestinal e invadir el tracto gastrointestinal. Por otra parte, es imprescindible la estabilidad permanente durante la vida útil del mismo y; contener un número adecuado de cepas viables que conduzcan al efecto beneficioso demostrado; con una nomenclatura específica, género y especie de la cepa definida; respaldado con evidencias científicas, estudios controlados de eficacia en seres humanos; almacenamiento, sustancias de vehículo que no afecten la vitalidad de la cepa; efectos beneficiosos y especificando claramente las características de forma veraz 11 en resumen, que sea seguro, funcional y tecnológico.
Otra principal característica es que por tratarse de un producto natural y biocompatible los probióticos regulan la expresión inmunologica a nivel de la mucosa sistémica y, a su vez corrigiendo la disbiosis intestinal cuyo resultado es la antibiosis de microrganismos perjudiciales entéricos. Éstos también han demostrado su efecto en relación a la creación de mucinas en las células epiteliales del sistema gastrointestinal, las cuales fungen como defensa antibacteriana reprimiendo la colonización por parte de entes infecciosos, capaces de resistir en el medio gastrointestinal5. Entonces, la utilización de los probióticos sea un visión que ha crecido al pasar de los años y más en los últimos tiempos, resaltando que son microorganismos vivos e inofensivos, usados por su acción terapéutica en diferentes patologías del organismo y que al ser administradas en cantidades adecuadas logran un beneficio para la salud del huésped10.
Se han sugerido algunos mecanismos para explicar el potencial alcance benéfico de los probióticos; en primer lugar, está la producción de bacteriocinas que inhiben la multiplicación de microrganismos nocivos; luego se encuentra la disputa por receptores celulares y tisulares, conocida también como inhibición competitiva con los patógenos o coagregación al biofilm, posteriormente, la degradación de toxinas, y por último la modulación de las funciones inmunitarias locales y sistémicas12.
Ahora bien, de un microorganismo propuesto como probiótico se presumen varios rasgos esenciales a fin de ser usado como medicación de patologías, como lo son la génesis de sustancias antimicrobianas, su desafío a las condiciones de la cavidad blanco, la ausencia de transmisión de plásmidos que codifiquen la resistencia bacteriana a otros agentes bacterianos, la sencillez y rapidez tecnológica en su procesado, ser aerotolerante, y obviamente sus propiedades y actividad demostrada in vivo.
En el caso de los beneficios en al organismo que origina el uso de los probióticos se pueden resumir en cuatro categorías a saber: 1) el suministro de nutrientes esenciales, que ayuda la absorción de vitaminas y aminoácidos , 2) el aprovechamiento de nutrientes no digeribles, en vista de que la microbiota permite la degradación de glúcidos que por propia cuenta del individuo muchas veces son indigeribles, 3) el antagonismo microbiano, evitando la proliferación de microorganismos patógenos y oportunistas y por último, 4) el perfeccionamiento de la inmunidad innata y la inmunidad adquirida, considerando que la presencia de estos microorganismos prepara al sistema inmune para la defensa en caso de una disbiosis en la que algún patógeno oportunista se desarrolle de manera descontrolada.13
Existen innumerables especies utilizados para el uso de probióticos, sin embargo, las bacterias ácido-lácticas son las de mayor uso, en particular los Lactobacillus, bacterias Gram positivas, catalasas negativas y normalmente con forma de bacilos14, son distinguidos como candidatos ideales para ser aprovechados como probióticos en la cavidad bucal, teniendo en cuenta su inocuidad en el hombre y que pocas veces se les relaciona con infecciones, producen el ácido láctico, un intermediario metabólico como producto final de la fermentación de carbohidratos y fuente de energía para el cuerpo humano15 y otras sustancias antimicrobianas como peróxido de hidrógeno, importante sustancia que desciende el pH luminal y a su vez el potencial de redox y bacteriocinas, péptidos bacteriostáticos, que contienen la multiplicación e instauración de bacterias patógenas que pueden provocar enfermedades16.
Lactobacillus spp son elementos básicos del biofilm oral del hombre, por lo que su consumo garantiza su inocuidad, permanencia y adaptabilidad siendo las más comunes L. acidophilus, L. casei, L. fermentum, L. gasseri, L. johnsonii, L. paracasei, L. plantarum, L. rhamnosus, L. salivarius, además de cepas de Bifidobacterium animalis presente en el intestino humano; también se emplean probióticos basados en las cepas no patógenas de Escherichia coli, que ayudan a diferentes trastornos en el intestino debido a que compiten con su contraparte patógena17. De la misma manera se emplean hongos, específicamente levaduras, como la Saccharomyces boularddii, una levadura de forma elipsoidal o esférica, que contiene una cápsula de polisacáridos, mientras que el citoplasma tiene la característica de presentar aminoácidos, enzimas, entre otros compuestos18; también es comuún el uso de Saccharomyces cerevisiae, levadura grandes, cuya forma varía entre elíptica y ovalada, de color blanco, crema, verde pálido o inclusive azul verdosas, su tamaño oscila entre 2 a 7 micras de largo, cuya característica microscópica es la presencia de ascosporas que obtengan acetato de potasio19, poseen una gran eficacia en distintas formas de diarrea20.Con respecto al término prebiótico fue introducido por Gibson y Roberfroid en el año 1995, definiéndolo como: “el segundo sustrato con beneficios para la salud, utilizado selectivamente por los microorganismos del huésped”21. No obstante en el año 2004, Gibson realizó una nueva definición, refiriéndose como “ingredientes que al ser fermentados selectivamente dan lugar a cambios específicos en la composición y/o actividad de la microbiota intestinal confiriendo beneficios tanto para la salud como para el bienestar del individuo”22. Por consiguiente, la Asociación Científica Internacional de Probióticos y Prebióticos (ISAPP, siglas en inglés) en el año 2013 propuso una conclusión para ello, describiéndolo como “microorganismos vivos los cuales cuando son administrados en adecuada cantidad confiere beneficios para la salud del huésped” y, años más tarde, en el 2018 ésta misma organización declaró un nuevo concepto: “sustratos que utilizados selectivamente por los microorganismos del huésped, confieren beneficios para la salud”22.
Por tanto, se entiende que los prebióticos son compuestos alimenticios no nutritivos que representan sustento para los microorganismos, produciendo elementos imprescindibles como ATP, micronutrientes y metabolitos los que son empleados por el hospedero a fin de estimular el incremento de ciertas géneros bacterianos que favorezcan el quilibrio de la microbiota (principalmente, bifidobacterias y lactobacilos). De allí que, los ingredientes alimentarios funcionen como sustratos para comportarse como prebioticos, en especial los oligosacáridos y los polisacáridos, por ser carbohidratos no digeribles.
Estos carbohidratos normalmente son parte de forma nativa de alimentos como leche, miel, hortalizas, verduras, frutas, cereales y legumbres. Un caso especial lo representan los frutos secos de los cuales se extraen los carbohidratos mediante su solubilización en agua o en soluciones acuosas y también por sistemas químicos o enzimáticos siendo la hidrólisis enzimática la destinada al utilizar condiciones más dóciles.
Los carbohidratos prebióticos producidos mediante síntesis enzimática se logran mediante reacciones químicas de transglicosilación donde actúan las enzimas b-fructofuranosidasa, b-galactosidasa y transglucosidasas entre otras, originando Fructooligosacáridos-FOS, polímeros de galactosa (GOS) y polímeros de manosa (MOS), respectivamente. Resulta interesante resaltar que varias de estas enzimas proceden no solo de bacterias, sino también de otros microorganismos como hongos y las reacciones pueden dar lugar a cocteles de oligosacáridos prebióticos innovadores. Incluso, mediante producción artificial se elaboran oligosacáridos prebióticos, tal es el caso de la lactulosa, un disacárido producto de la isomerización de la lactosa utilizando catalizadores básicos23.
Ahora bien, para que un producto, ingrediente o alimento sea contemplado como un prebiótico debe completar una serie de requerimientos: Ser acidorresistente, permanecer inalterable ante la hidrólisis por enzimas digestivas y no absorberse en el intestino delgado. A su vez permanecer indigerible ni poder hidrolizarse en el tracto gastrointestinal (GIT) superior y; adicionalmente ser fermentable de manera selectiva por bacterias benéficas de la microbiota y por último ser capaz de inducir efectos fisiológicos saludables para la salud24.
Cabe señalar que los alimentos fermentados, aunque constan de muchos microorganismos sirviendo como probióticos, no cumplen los requisitos mencionados previamente; por lo tanto, los microorganismos utilizados para la fermentación no tienen como objetivo principal servir como sustrato para prebióticos, aunque una vez separados logran ser usados como compuestos en la producción de algunos alimentos, de ahí que la mayoría de los prebióticos utilizados en medicina general y odontología se han derivado de la industria de la fermentación25.
Entre las ventajas de administrar prebióticos está el fortalecer la microbiota endógena, ya que son su sustrato y activan su desarrollo, aumentando el antagonismo frente a microorganismos perniciosos, al mismo tiempo que auspicia la recolonización microbiana. En vista de ello, es importante mencionar que el metabolismo de los prebióticos se da en condiciones de anaerobiosis, lo que favorece la producción de ácidos grasos de cadena corta (AGCC), con su efecto trófico en los enterocitos y neutralización de los grupos amonio generados por desaminaciones de aminoácidos unido a la producción de Dióxido de Carbono CO2 e Hidrogeno H2, provocan la inhibición del crecimiento de ciertas bacterias patógenas análogas.
Otros elementos producto del metabolismo de los prebióticos por parte de la microbiota como el ácido acético interviene en la síntesis de lípidos y el ácido propiónico en el catabolismo de glúcidos, de allí que añadir prebióticos a la dieta mejora la barrera mucosa digestiva y modula las funciones tróficas de la microbiota, siendo sus efectos beneficiosos para el huésped26.
De allí que los prebióticos se proyecten como soporte para la microbiota originando energía, sustratos y nutrientes para el hospedero, estimulan el crecimiento selectivo de determinadas especies beneficiosas, que en caso de la cavidad bucal serían principalmente Bifidobacterias spp y Lactobacilos spp. Por otro lado, en el mercado mundial se comercializan como prebiótico, un gran número de carbohidratos, mostrándose solamente la evidencia científica de sus propiedades en humanos los fructanos tipo inulina y los fructooligosacáridos (FOS), los galactooligosacáridos (GOS), la lactulosa y los oligosacáridos de leche humana27.
Como se mencionó anteriormente, el término simbiótico se refiere a productos que consisten tanto en probióticos y prebióticos. Gibson y Roberfroid propusieron por primera vez los prebióticos en 1995 para promover la simbiosis en la microbiota intestinal. Dicho esto, se entiende que esta combinación llamada simbiótico se fundamenta en que el prebiótico estimula el desarrollo del probiótico, consolidando su viabilidad y potencializando sus cualidades. Pues bien, un a un simbiótico le corresponde demostrar las siguientes propiedades: ser de origen natural, cuyo aislamiento y purificación haya sido por técnicas no desnaturalizantes, además de exponer una efecto favorable por encima que el de sus componentes de forma individual mejorando las funciones fisiológicas y actuando de forma preventiva o curativa28. Hoy en día, existe evidencia clara de que los simbióticos mejoran la función inmunológica del huésped, favoreciendo selectivamente las bacterias promotoras de eubiosis, como Lactobacilli y Bifidobacteria, empleando sitios potenciales de adhesión de cepas patógenas, ejerciendo así propiedades antiadherentes y reprimiendo la virulencia de patógenos humanos per se25.
Como bien se sabe, la microbiota bucal alberga una gran cantidad de microorganismos, conocidos por las innumerables investigaciones, proyectos y estudios que se han encargado de estudiarla a lo largo de los años, siendo éste un proceso bastante complejo, ya que se han considerado como especies únicas, además de que establecen diversas relaciones en conjunto, es por ello resaltar a la “Human Oral Microbiome Database”, ya que han generado e impulsado a la comunidad científica con respecto a la información sobre géneros y especies bacterianas presentes en el tracto aerodigestivo humano (incluyendo a la cavidad oral), donde se obtuvo un resultado de 770 especies microbianas, donde el 57% están designadas con sus respectivos nombres, pero el 13% aún no lo tiene y el 30% son filotipos no cultivados29.
Por otra parte, la OMS define a la salud oral como “ausencia de dolor orofacial, cáncer de boca o de garganta, infecciones y llagas bucales, enfermedades periodontales, caries, pérdida de dientes y otras enfermedades y trastornos que limitan en la persona afectada la capacidad de morder, masticar, sonreír y hablar, al tiempo que repercuten en su bienestar psicosocial”30. En tal sentido, muchas de las enfermedades odontológicas se enfocan en lo concerniente a la disbiosis en los ecosistemas orales, con el rompimiento del balance de los miembros de la microbiota oral, tal es el caso de la caries y la periodontitis.
Sin embargo, la llegada de la caries dental y enfermedades periodontales, consideradas en primera instancia como las patologías que desatan la disbiosis oral, inducen a diversos cambios que repercuten al equilibrio de la misma, debido al consumo excesivo de polisacáridos y sacarosa, provenientes de la salida por los iones de fosfato y calcio del esmalte, generando el aumento de la disponibilidad de sustratos y de esta manera la producción de ácidos.
De allí que, los alimentos ricos en azucares se consideran uno de los factores generadores de una microbiota cariogénica. Por el contrario, la disbiosis que desencadena a la periodontitis se alcanza por una microbiota proteolítica, producida por una incorrecta higiene bucal y malos hábitos (el tabaquismo, diabetes mellitus, consumo de alcohol o genética), favoreciendo la fractura de la eubiosis bucal y la aparición de respuestas inflamatorias asociadas a daños tisulares crónicos. De allí que, la disbiosis oral se considera como un elemento que puede impactar de una manera negativa en la salud tanto oral como sistémica29.
En función a lo anteriormente expuesto, es importante comprender sobre la caries y enfermedades periodontales, debido a que son reconocidas como las patologías bucales de mayor incidencia mundial, por ende, es necesario establecer una noción sobre cada una de ellas.
Actualmente la caries dental se maneja bajo una concepción más ecosistémica identificándose como una alteración derivada de la fragilidad ecológica, relacionada con el aumento del consumo de carbohidratos fermentables que ocasionan un desequilibrio en la constitución y actividad del biofilm con una pérdida inorgánica en los dientes suscitada por los ácidos producto del metabolismo microbiano de los carbohidratos31.
De allí que se hable de conceptos como “Proceso de caries”, definiéndose por ser una sucesión activa de interacciones diente/biofilm que ocurren sobre y dentro de una superficie dentaria en un determinado lapso de tiempo; este proceso advierte un cambio en el balance entre la desmineralización como factor protector a favor de la desmineralización de la estructura dentaria; por tratarse de un proceso dinámico, este puede interrumpirse en cualquier momento, mientras que la “lesión cariosa”, es aquel cambio detectable en la estructura dentaria que resulta de la interacción diente/biofilm, en efecto, es la manifestación clínica, el signo, del proceso de caries32.
Sin embargo, el desequilibrio de la microbiota bucal que puede desencadenar el proceso de caries se relaciona estrechamente con la variedad de microorganismos ubicados en el bioflim a nivel de las superficies dentales cuyo metabolismo acidógeno, acidúrico y acidófilo ocasiona la destrucción de los tejidos. Por otra parte, variables que influyen directamente sobre estos depósitos microbianos son los trastornos salivales, gastrointestinales, el vomito, la ingesta de alimentos ácidos y el alto contenido de sacarosa en la dieta, que, en conjunción al estilo de vida, los hábitos de las personas y factores hereditarios que generan susceptibilidad en los pacientes dan origen a la lesión cariosa33.
Entre los microorganismos involucrados para este proceso infeccioso se mencionan en primera instancia al Streptococcus mutans, microorganismo de forma esférica, gram positivo, anaerobio facultativo, cuyo metabolismo fermentativo destaca su capacidad acidogénica, acidúrica y acidófila, dando origen a la producción de exopolisacáridos como los glucanos y fructanos a partir del catabolismo de la fructosa y la glucosa, que participan activamente en la adherencia bacteriana.
En tal sentido, la patogenicidad de S. mutans se concreta en su actividad metabólica; gracias a las enzimas Glucosiltransferasas y Fructosiltransferasas responsables de la producción de compuestos extracelulares como glucanos y fructanos, que agilizan la instalación y el crecimiento de otras bacterias en la superficie del diente. También, la producción de polisacáridos endógenos conocidos como “IPS”, los cuales, permiten al S. mutans utilizarlos como un sustrato alternativo en escasez de carbohidrato para prolongar las condiciones que favorecen el desarrollo de la l caries y por último la producción de mutacinas, sustancias producto del anabolismo bacteriano que reprimen a otros microorganismos, lo que beneficia el avance y la persistencia de sí mismo34.
También están asociadas al mismo proceso S. sobrinus, Lactobacillus spp, y Bifidobacterium spp que son anaerobias grampositivas, inmóviles, sacarolíticas, no esporulantes35 y Propionibacterium, una bacteria de crecimiento lento, anaerobia, Gram-positiva, con ciertas particularidades fisiológicas que favorecen la colonización en entornos abundantes en ácidos grasos, tal es el caso de los folículos sebáceos, también ayuda a catabolizar los triglicéridos que se encuentran nichos lipídicos que invade, transformandolos en ácidos grasos de cadenas ligeras, dando como derivado de esta fermentación al ácido propiónico, que contribuye al mantenimiento del ambiente favorable para la microbiota36.
A pesar de sus marcadas individualidades, estos microbios coinciden en algunos aspectos como el formar parte de la biopelícula, constituida por microrganismos que se establecen como ecosistemas organizadamente; con una dinámica metabólica activas; inducir alteraciones en el pH salival; disminuyendo el pH a 5,5, creando entornos ácidos, desencadenando la pérdida mineral que conduce a la disolución de los tejidos duros y que es simplemente visible en una etapa más tardía.
La pérdida mineral, o lesión cariosa se presenta inicialmente como una mancha blanca opaca; percibiéndolas al tacto rugosas con una ubicación muy cercana al margen gingival: recubiertas por depósitos dentobacterianos en su estado activo; De allí que, mediante la desorganización de la biopelícula con métodos mecánicos tales como el cepillo de dientes y la seda dental pueda detenerse la lesión y luego ser remineralizada, no obstante, una vez interrumpidas estas lesiones, se perciben notables cambios ; al tacto son lisas, se observan brillantes y se alejan de la zona gingival. Es interesante destacar que este fenómeno de la remineralización de las lesiones cariosas se presenta únicamente si quedan cristales parcialmente mineralizados que logran su tamaño normal en un medio supersaturado32.
En cuanto a las enfermedades periodontales, se catalogan en dos principales grupos gingivitis y periodontitis, ambas originadas la variación en el ecosistema de la microbiota oral, que motiva el incremento de microorganismos infecciosos con respecto a los residentes; los cuales interactuando con el hospedero y simultáneamente con los factores de riesgo del paciente, precisarán una manifestación clínica particular. Por tanto, hace referencia a una alteración de origen multifactorial que afectan a individuos susceptibles a nivel del periodonto, expresándose en forma de gingivitis y periodontitis.
El principal factor etiológico es el biofilm de la placa dentobacteriana, además del número de bacterias implicadas en el mismo, generando una intensa activación del sistema inmunitario, la cual si no es diagnosticada de forma temprana existirá una alta probabilidad de progresión que inclusive podrá llegar a la perdida de unidades dentarias37.
Así pues, se caracteriza por el comienzo de la inflamación gingival por parte del huésped, conllevando a la progresión y por ende daño en la inserción periodontal, sin embargo, esto dependerá de la disbiosis en la microbiota, es decir, de la disponibilidad de nutrientes, degradación tisular que favorecen a algunos géneros bacterianos y por supuesto de ciertos mecanismos que puedan generar la competencia existente entre el microbioma a nivel del surco gingival después que se haya desencadenado la inflamación38.
Haciendo una diferenciación más definida se encuentra la gingivitis, cuya etiología está, relacionada con agentes infecciosos, principalmente, y, en otros casos con condiciones sistémicas, caracterizada por inflamación clásica, en vista de que presenta los signos de calor, rubor, dolor y tumefacción a nivel de encía marginal, y encía adherida, que cursan siempre de forma reversible37.
Clínicamente se genera una encía eritematosa blanda y depresible cuyo sangrado únicamente deriva de la exploración con sonda, progresando a una gingivorragia espontánea, no se presenta pérdida de tejidos de soporte, sin embargo, es muy frecuente la halitosis, particularmente en pacientes con escasa higiene oral.
En el caso de la Periodontitis, su etiología se relaciona principalmente con el progreso de una gingivitis infecciosa, perjudicando a los tejidos de soporte del diente y sacrificando lentamente al ligamento periodontal y al hueso alveolar, de forma definitiva.37 Su comienzo se relaciona principalmente con la presencia de bacterias periodontopatógenas verdaderos como lo son Agreggatibacter actinomycetemcomitans, bacteria Gram-negativa anaerobia facultativa con capacidad para producir una serie de factores de virulencia, expresa adhesinas la cual facilita su colonización y la producción de exotoxinas39 y Porphyromona gingivalis una bacteria Gram-negativa, anaeróbica, en forma de bastón responsable de la forma crónica de la periodontitis, ya que puede remodelar la comunidad bacteriana comensal para promover un estado de disbiosis40.
Asimismo se encuentran los microorganismos Prevotella intermedia, bacteria anaerobia Gram-negativa de pigmento negro, suele encontrarse generalmente en la placa subgingival de personas con enfermedad periodontal41, Veillonella recta bacteria gramnegativa con forma de cocos pequeños, anaeróbicas obligadas, inmóviles, no formadoras de esporas42 y Fusobacterium nucleatum bacteria Gram-negativas, consideradas como un patógeno periodontal, debido a su mayor prevalencia dentro de la biopelícula subgingival, sus propiedades de virulencia adicionales encierran su actividad hemolítica mejorada y la producción de sulfuro de hidrógeno43. Es así, como por acción microbiana, por una parte y gracias a la respuesta inmune individual del hospedador por otra se desarrolla en mayor o menor medida la enfermedad periodontal, no obstante, la existencia de factores previos como el trauma oclusal, la inmunosupresión o alguna patología sistémica simplifican la instauración y progreso de la enfermedad38.Por último, es interesante mencionar que tanto en la caries dental como en las enfermedades periodontales se presenta el signo clínico de la halitosis o mal aliento, resultado de la creación y liberación de compuestos aromáticos por parte de la microbiota residente.
Pues bien, un gran porcentaje de esta halitosis tiene su inicio en el metabolismo de microorganismos , responsables de otras patologías orales44 que habitan en nichos de difícil acceso para la higiene como el surcogingival y el dorso de la lengua, lo que facilita la acumulación de residuos alimenticios proveniente de la dieta del individuo que les sirven para su nutrición y desarrollo de colonias, habilitando la elaboración de ácidos grasos volátiles de cadena corta y compuestos volátiles sulfurados, como lo son el Metilmercaptano CH3SH, el Sulfuro de hidrógeno H2S, el Dimetilsulfuro CH3S y el Dimetildisulfuro (CH3)2S2; siendo estos complejos el resultado de la metabolización de aminoácidos sulfurados por las bacterias bucales y causantes directos del mal olor45.
Principalmente, los depósitos dentobacterianos que se establecen en torno a los tejidos bucales se distinguen como el principal elemento etiológico de la mayoría de las patologías de índole infeccioso que se presentan en la cavidad oral. A su vez, los atributos de la población bacteriana dentro de la biopelícula, incrementada por un deficiente mantenimiento de la higiene oral predispone a cambios dentro de esta microbiota bacteriana hasta quebrantar el equilibrio en el microbioma y el hospedador.
Ahora bien, la interpretación de los saberes suscitados producto de los estudios del microbioma y su compleja interacción con el huésped, interconectados con el efecto de principios genéticos y epigenéticos, evidencian el uso de probióticos, prebióticos y simbióticos, como recurso terapéutico a manera de desafío, tomando en cuenta que actualmente, múltiples estudios destacan la unión de diversas especies y sus efectos benéficos en la salud.
Y, si es indiscutible el progreso alcanzado en la aplicación de estos productos, sin embargo, a nivel de la microbiota bucal aún no hay consenso acerca de las conjunciones ideales de microorganismos, la dosis, la especificación estructural y funcional de los compuestos, los métodos comunes de acción para obtener el efecto benéfico, así como la forma de administración.
Los resultados más importantes señalados tras la administración probiótica, concernientes a la caries dental son la reducción en recuentos salivales de S.mutans, la disminución de manera destacada de los niveles de depósitos dentobacterianos lo cual se relaciona con el aumento del pH salival y por otra parte, en lo referente a la enfermedad periodontal se ha demostrado un rol tanto preventivo como terapéutico, en etapas tempranas de la enfermedad46.
También se ha evidenciado que la administración de probióticos ocasiona una mejora en los signos clínicos evaluados en las enfermedades periodontales. Alguno de estos efectos son la disminución de la profundidad de la bolsa, el avance en el nivel de inserción gingival, la reducción del sangrado al sondaje, el declive de los valores de microorganismos periodontopatógenos y una clara mengua de los niveles de placa, que ya ha sido comprobada en caries dental47.
Por otra parte, los resultados obtenidos tras la exploración de la correspondencia entre probióticos y halitosis han sido ciertamente finitos. La mayoría de los ensayos demuestran que la disminución del mal olor en individuos con mal aliento se relaciona con la baja de los niveles de compuestos volátiles sulfurados presentes en la biopelicula posterior a la administración de probióticos 48.
Ahora bien, por ser Streptococcus spp el principal microorganismo involucrado en la génesis de la caries, han sido numerosos los estudios realizados relacionados con el efectos de los bióticos sobre él; tales como los realizados por Elnaz et al. sobre el eficacia del yogurt con probiótico y gomas de mascar que contienen xilitol en la reducción de los niveles salivales del Streptococcus mutans, comprobando lo efectivo que son en el descenso de los niveles de S. mutans en saliva, y hasta ahora recomiendan su consumo frecuente para prevenir la caries49. Por otra parte, Sung-Hoon et al también efectuaron un estudio sobre el efecto de los probióticos, pero esta vez en un modelo de biopelícula cariogénica para prevenir las caries dentales valorando toda la actividad antimicrobiana de tres tipos de probióticos contra los Streptococcus spp. orales durante la formación de la biopelícula con bacterias salivales incluyendo Streptococcus mutans, percibiendo el efecto inhibitorio en el establecimiento del modelo de la biopelicula cariogénica. De allí que el uso de probiótico para la regulación de la biopelicula bucal es significativo para la prevención de lesiones cariosas50.Asimismo, la composición de la biopelícula subgingival es la demostración de las interacciones dinámicas del microambiente, de la estructura microbiana y la congregación de microbios comensales que cohabitan en recíproco equilibrio, y analizando que la boca hospeda aproximadamente setecientas especies bacterianas, que comprenden microorganismos residentes, transitorios y patógenos; por tanto, la armonía entre ellos determinará, en gran parte, el estado de salud o de enfermedad del sujeto. Sin embargo, si este ecosistema bucal se modifica, consecuencia de la inflamación de los tejidos, el estado de disbiosis influye a tal punto que se estimula el desarrollo de los integrantes más virulentos de la biopelícula, que como secuela provocaría la inflamación gingival51.
Las actuales revisiones sistemáticas relacionadas con la eficacia de los probióticos destinados a la terapia periodontal afirman un potencial resultado favorable en la reducción de la pérdida de inserción y profundidad de sondaje de bolsas en casos de periodontitis activa, de allí que sean designados como terapia coadyuvante, manifestando reiteradamente un valor positivo al descender los índices gingivales y la abundancia de depósitos dentobacterianos. Estudios también han destacado el uso de probióticos como un recurso terapéutico frente a signos de enfermedades bucales; sustentándose en dos grandes estrategias contra las enfermedades periodontales, la supresión de patógenos específicos y la interrupción de la respuesta destructiva del huésped, de allí que se ha llegado a pensar en el enfoque de la terapia con probióticos para lograr el objetivo en estos tratamientos.
Estudios también han destacado el uso de probióticos en la modulación del eje intestino-cerebro presentándolos como un recurso terapéutico frente a síntomas de ansiedad y depresión; también se ha propuesto su uso en el tratamiento de enfermedades cutáneas y la cavidad oral.
Los resultados del probiótico Lactobacillus reuteri sobre el microbioma fue objeto de estudio por Iniesta et al., quienes suministrando por vía oral este producto investigaron, recogiendo y analizando durante ocho semanas las muestras subgingivales y de saliva estimulada y no estimulada, para posteriormente, realizar cultivos microbiológicos anaerobios y PCR teniendo en cuenta como variables clínicas el índice de placa e índice gingival. Sin embargo no se detectaron cambios estadísticamente significativos desde el punto de vista clínico; pero los recuentos totales en saliva de microorganismos anaeróbicos después de cuatro semanas al igual que los recuentos de Prevotella intermedia revelaron un descenso en el grupo de prueba. Por otro lado, las muestras de biofilm subgingival tomadas inicialmente y a las cuatro semanas presentaron una reducción significativa para el recuento de Porphyromonas gingivalis y en el PCR se detectó mayor una frecuencia del probiótico Lactobacillus reuteri ATCC-PTA-5289 que del producto biológico Lactobacillus reuteri DSM-17938, concluyendo los autores que el efecto de Lactobacillus reuteri administrado en tabletas reflejó disminución en la representación de patógenos periodontales distinguidos en el microbioma subgingival52.
Por otra parte, un estudio sobre la evaluación y administración oral diaria de bacterias probióticas realizado por Hallstrom et al. se plantea que éstas podrían intervenir en la composición de los depósitos bacterianos supragingivales, los parámetros clínicos y en los niveles de los mediadores inflamatorios en un modelo de gingivitis experimental. Este estudio clínico doble ciego se formalizó la ingesta de pastillas de disolución oral con Lactobacillus reuteri (grupo experimental) y pastillas de disolución oral con placebo (grupo control) dos veces al día; una vez culminada la investigación no se hallaron diferencias representativas entre los conjuntos que supongan que la utilización de Lactobacillus reuteri afecte el acúmulo de placa, las transformaciones inflamatorias gingivales o la abundancia de biopelícula en la gingivitis experimental53.
Slawik et al en su estudio resolvieron identificar los alcances de una bebida de leche probiótica consumida durante un periodo de veintiocho días y su efecto con respecto a la expresión de los parámetros clínicos inflamatorios en la encía durante varias fases de la gingivitis inducida por biopelícula en adultos jóvenes que no realizaron cepillado dental y concluyeron que el consumo diario de una bebida láctea con probióticos reduce los efectos de la formación de la placa bacteriana. Del mismo modo se ha observado que los probióticos tienen la capacidad de reducir los recuentos de Streptococcus mutans en la saliva y biopelícula y que influencian positivamente los resultados clínicos del raspaje y alisado radicular en pacientes con periodontitis, disminuyendo también la halitosis.54
Otro aspecto interesante relacionado con el efecto de los “Bioticos” en el hospedero se relaciona con la inmunidad innata y adquirida13. Modulando el sistema inmunológico de la mucosa bucal e intestinal a través del control del balance de citoquinas proinflamatorias y antiinflamatorias, manteniendo un estado de “inflamación controlada” de manera de prevenir la invasión de patógenos causantes de enfermedades55.
Ahora bien, se aprecia que los probióticos y sus productos extracelulares interactúan con las células y mucosas del huésped, determinando de manera específica por cepa la producción de citocinas y quimiocinas, que conducen a la actividad fagocítica mejorada por macrófagos, neutrófilos y Células Natural Killer (NK). Es interesante destacar que los probióticos, no sólo actúan sobre la inmunidad innata, sino que también intensifican la inmunidad adaptativa al aumentar los niveles de IgA en el suero y regulando el desarrollo de células T auxiliares y la proporción de Células Th1/Th2; sin embargo, a nivel oral, se ha explicado menos.
De hecho, los probióticos específicos inhiben la respuesta de la interleucina-8 (IL-8) de las células de la mucosa oral causada tanto por algunos patógenos periodontales como por otros biomarcadores inflamatorios, como prostaglandina E2 (PGE2) Aun así, no se ha observado ninguna alteración en los niveles de IgA salival observado25.
De igual manera, tanto los prebióticos como los probióticos han tenido gran relevancia en pediatría para tratar diversas enfermedades, entre ellas las afecciones a nivel gastrointestinales, alergias y en la prevención de infecciones. La Organización Mundial de Gastroenterología (WGO), en su última actualización en 201756 ampliaron el número de preparados con probióticos para la diarrea infantil, siendo las cepas con mayor evidencia científica los Lactobacillus rhamnosus y Saccharomyces boulardii, pero han rebajado el grado de recomendación de las mismas, sin embargo se sigue afirmando que las cepas con evidencia científica suficiente las consiguen ellas. La eficacia de los probióticos en el tratamiento de la diarrea aguda en los niños se produce al acortar en un día la duración del episodio, al segundo día de tratamiento disminuye el número de deposiciones y el porcentaje de diarreas que se prolongan más de cuatro días. Parece que los efectos beneficiosos son más notables cuanto más precozmente se administran los probióticos en el curso de la enfermedad y no se observan efectos adversos con su administración56.
Por ende, los probióticos actúan: mejorando la motilidad intestinal, contribuyen al estreñimiento en niños, en la enfermedad celíaca y en infección producida por Helicobacter pylori, modificando la percepción de dolor intestinal por inhibición de la contractilidad y disminuyendo la inflamación intestinal, así como la inhibición del crecimiento de bacterias coliformes productoras de gas en niños con cólicos. El empleo de los prebióticos aumenta la capacidad de retención de agua de las heces y estimula el crecimiento de las bifidobacterias, aumentando la media de deposiciones y disminuyendo su consistencia. Cabe destacar que dicha investigación está abriendo futuras puertas en las aplicaciones en la obesidad y en los trastornos del comportamiento, como es el caso del autismo56.
Por otro lado, Tao et al en 2020 realizaron un metaanálisis acerca de la eficacia de los probióticos en la Diabetes Mellitus II, llegando a concluir que el tratamiento con probióticos puede reducir la HbA1c (hemoglobina glicosilada), FBG (determinación de glucosa en sangre en ayunas) y el nivel de resistencia a la insulina a pacientes que lo padecen. Aparte de que la diabetes mellitus es una enfermedad causada por múltiples factores de riesgo, como la edad, genética, malos hábitos, entre otros. Y teniendo en cuenta todos los síntomas gastrointestinales que presenta el paciente con diabetes, se puede sospechar que la microbiota intestinal está involucrada en la patogénesis de ésta enfermedad sistémica57. Variables estudios realizados a distintos pacientes con diabetes mellitus avanzadas y otros no tanto, se sugiere que el consumo de probióticos, prebióticos o simbióticos puede ser un tratamiento adyuvante potencial para mejorar los resultados metabólicos58.
En función a lo expuesto, todos los resultados muestran que los probióticos son competentes en la eubiosis bucal, recomendándose, así como elemento complementario contra la enfermedades de origen dentobacteriano.4
Son otro elemento a considerar dentro de los elementos del sistema inmunológico; según Ortiz et al "Las defensinas son péptidos catiónicos no glicosilados, que contienen seis residuos de cisteínas que forman tres puentes disulfuro, responsables de la estructura beta plegada, y son abundantes en células y tejidos que participan en la defensa del huésped contra infecciones microbianas"7, que son liberadas a través de las células epiteliales por acción de las cepas probioticos o por la estimulación generada por algún agente patógeno es por estas razonas que se les reconocen como uno de los péptidos antimicrobianos más importantes para los mamíferos incluyendo a los humanos59.
Las defensinas se clasifican en: α, β y θ (solo las α y β se ubican en los seres humanos), donde se diferencian entre sí por la longitud de sus aminoácidos, la posición del disulfuro en la cadena y la expresión celular, sin embargo se destacará al subtipo β, tienen de 38 a 42 residuos de aminoácidos y tres enlaces disulfuro entre los seis residuos de cisteína de los péptidos maduros7, donde alguna de las βdefensinas tienen la característica de eliminar al patógeno sin elevar la inflamación, éstas están distribuidas en diferentes epitelios del cuerpo humano y contribuyen con la protección de diferentes zonas mucosas del cuerpo humano.
El mecanismo de acción consiste en "la interacción de cargas positivas de éstos y la carga negativa de las membranas de las bacterias y virus; una vez que interactúan entre sí, las defensinas se acumulan en la membrana de los microorganismos y causan despolarización, lo que induce su muerte"7. En la cavidad oral (encía, lengua, glándulas salivales) se encuentran altas cantidades de las β defensinas humanas,1 3 tienen acción antimicrobiana (principalmente con las bacterias criogénicas), antifúngica y hemostática, que participan activamente en la defensa de la pulpa dentaria ubicándose en la parte más externa de la misma, una vez que los receptores detectan la presencia de microorganismos se activa una vía de señalización que activa la liberación de las βdefensinas y a su vez la liberación del óxido nítrico que, en conjunto eliminan bacterias, virus, parásitos y hongos. Y a su vez la liberación de las βdefensinas atrae células inflamatorias debido a que su presencia aumenta la producción de las quimiocinas.
Cada una de las beta defensinas humanas (hBD por sus siglas en inglés) poseen características propias (tabla 1), la elevación de la producción de estas puede ser utilizada para indicar la presencia de patologías en la cavidad oral, diversos estudios (Tabla 2) han realizado estas pruebas usando como referencia la presencia de las hBD en la enfermedad peridodontal debido a la correlación que existe entre ellas y los procesos inflamatorios, los estudios revelaron que el aumento de las hBD está presente en los pacientes con enfermedad periodontal como en los pacientes sanos. Lo que determinara su aumento será el estado de salud del paciente como la zona del tejido periodontal utilizada para el estudio, como por ejemplo tenemos a Ebrahem, 201362 cuyo estudio se basó en la presencia de las hBD 1, 2 y 3 en el fluido crevicular en pacientes con periodontitis agresiva posterior a tratamientos periodontales no quirúrgicos, en los cuales se obtuvo como resultado el incremento de las hBD 1 y 3 posterior al tratamiento.
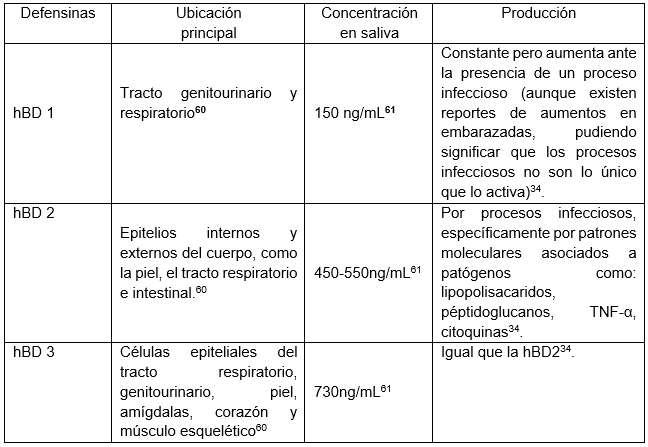
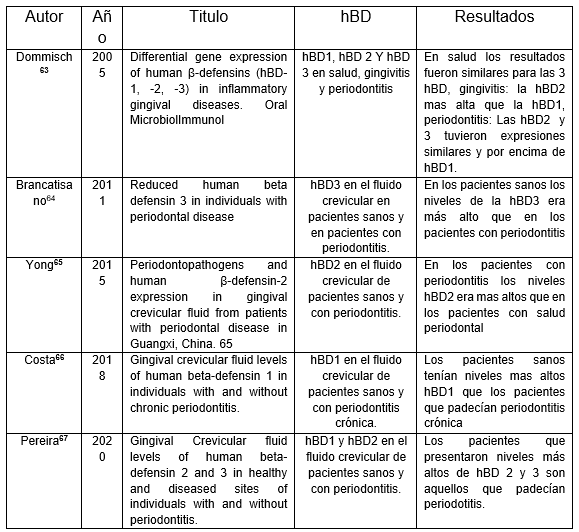
Todos los estudios llegan a una misma conclusión principalmente podemos observar que en los pacientes con enfermedad periodontal que hay un aumento significativo de las hBD 2 y 3, esto, consecuencia de que la producción se eleva en procesos infecciosos o inflamatorios, en cambio hBD1 expresan una menor cantidad debido a que esta es producida constantemente, por tanto, la creación no disminuye, sino que las otras defensinas son producidas con mayor cantidad como medida de respuesta.
Para lograr un equilibrio simbiótico en la cavidad bucal es ideal obtener una adecuada transformación de nitrato de los alimentos en nitrito mediada por enzimas nitrato reductasas (presentes en las bacterias) hecho que conlleva a asumir que este elemento tiene acción antiinflamatoria y antimicrobiana. Asimismo, posee un efecto en la mucosa gástrica; contribuyendo a la homeostasis metabólica y cardiovascular; unido a la capacidad de actuar con el sistema inmune para el control y crecimiento del huésped y preservar en la superficie de las mucosas su morfología generando acciones perjudiciales en la migración de bacterias asociadas a caries dental y periodontitis68.
El cuerpo humano no tiene la capacidad de metabolizar el nitrato en sí, pero existe varios procesos enzimáticos y no enzimáticos para convertir el nitrito en óxido nítrico. Tal es el caso del jugo gástrico ácido, es decir, parte del nitrito se descompone en nitrógeno reactivo, como el óxido nítrico (NO), la cual tiene la capacidad de mejorar los efectos bactericidas de jugo gástrico. Además, en los vasos sanguíneos, el nitrito puede reaccionar con la hemoglobina y mioglobina para formar óxido nítrico, que además de ser antimicrobiano, también es un importante regulador cardiometabólico del cuerpo humano, presente en vasodilatación, función endotelial, antiagregación de plaquetas, transmisión nerviosa, función mitocondrial, respuesta inmune, metabolismo óseo y apoptosis69.
Ahora bien, la adición de nitrato a las comunidades orales condujo a una rápida modulación de la composición y actividad del microbioma, considerándolos como beneficiosos para el huésped (es decir, aumento de la eubiosis o disminución de la disbiosis). Por lo tanto, el nitrato debe ser investigado como un prebiótico potencial para la salud oral69.
Una de sus principales funciones está en disminuir a las bacterias asociadas a caries, halitosis y enfermedad periodontal. Por ende, los datos in vitro e in vivo, indican que el nitrato puede limitar o prevenir caídas de pH cuando los azúcares son fermentados por la microbiota oral, un mecanismo de resiliencia que podría ser estimulado por el consumo de extractos vegetales ricos en nitrato.
Los principales mecanismos de amortiguación del pH por parte del nitrato son el uso de ácido láctico durante la desnitrificación (observado tanto in vivo como in vitro) y durante la reducción de nitrito en amonio, así como la producción potencial de amoniaco (observado in vitro). En esta los efectos del nitrato se observaron después de períodos cortos, es decir, después de 5-9 h de incubación in vitro y 1-4 horas después de la ingesta del suplemento de nitrato in vivo, se aislaron bacterias reductores de nitrato pertenecientes a los géneros Rothia y Actinomyces. Una selección de aislados de Rothia aumentó el uso de lactato y la capacidad de reducción de nitratos de las comunidades bucales, lo que potencialmente beneficiaría la salud dental y la salud sistémica, respectivamente68.
Por consiguiente, el nitrato puede modular la microbiota de manera que parecen ser beneficiosas para el huésped y, por lo tanto, pueden ser considerados como una sustancia prebiótica potencial para disminuir potencialmente la caries, la halitosis y la enfermedad periodontal asociada a gérmenes70.
Mientras que, el óxido nítrico es un producto de vida corta del metabolismo del nitrógeno, producido por muchas células del organismo con funciones biológicas importantes. Actúa como relajante derivado del endotelio del músculo liso vascular, inhibidor de la agregación y la adhesión plaquetarias y mensajero neuronal. Asimismo, sintetizado en grandes cantidades por los macrófagos activados, es una molécula citotóxica que influye en la capacidad de las células para matar bacterias, virus y protozoos, así como células tumorales70.
La evidencia científica demuestra que en la práctica odontológica los bióticos cumplen un rol significativo para mantener la eubiosis de la microbiota bucal, ya que es considerada como una excelente alternativa para tratar la fisiopatología que alteran y afectan la salud bucodental, entre las que se destacaron principalmente: caries y enfermedad periodontal, como también su relación con las enfermedades sistémicas que con su uso moderado y constante serán capaces de lograr efectos importantes, logrando así beneficios satisfactorios para los mismos.
Recordando que los bióticos son una excelente vía terapéutica para producir agentes antimicrobianos, generando reducción y tratamiento de enfermedades, degradación de toxinas, e inclusive optimizar al sistema inmunológico a través del uso de las defensinas y producción de óxido nítrico (NO), reconociendo por parte del campo odontológico a los bióticos como una alternativa útil para reducir de una manera significativa las enfermedades que afectan a la microbiota.
Por ende, son considerados como el futuro en la odontología para prevenir la disbiosis, sin embargo, es conveniente realizar más estudios y búsquedas acerca de estos productos biológicos, y sí asegurar el éxito microbiológico, clínico y preventivo en la microbiota bucal.
Nada que declarar.
María Cristina Aguilera Monroy: Redacción del artículo, análisis de datos/interpretación de datos, revisión crítica del artículo, aprobación del artículo, acuerdo para responsabilizarse de todos los aspectos del trabajo. Ana Virgina Henríquez Ramos: Redacción del artículo, análisis de datos/interpretación de datos, revisión crítica del artículo, aprobación del artículo, acuerdo de ser responsable de todos los aspectos del trabajo. Dielimar B Molina O: Redacción del artículo, recogida de datos análisis de datos/interpretación de datos Cruz A Monzon R: Redacción del artículo, recogida de datos análisis de datos/interpretación de datos Verushka W Pacheco G: Redacción del artículo, recogida de datos análisis de datos/interpretación de datos
Los autores declaran no tener ningún conflicto de intereses.
Datos disponibles previa solicitud a los autores.