Objetivo: Evaluar el daño genotóxico y citotóxico, asociado a la presencia de aparatología ortodóncica fija gemelar y de autoligado, en pacientes atendidos en la clínica de ortodoncia de la Universidad Cooperativa de Colombia Campus Pasto. Materiales y métodos: Se llevo a cabo un estudio observacional, descriptivo, longitudinal, de temporalidad prospectiva. Se realizó un frotis a 30 pacientes, entre los 18 a 40 años, que acudieron a la clínica de ortodoncia de la Universidad Cooperativa de Colombia - Campus Pasto, previo a la cementación de aparatología ortodóncica fija tanto gemelar como de autoligado, se hizo una nueva toma a los 7 días y otra a los 3 meses. De acuerdo con las pruebas de normalidad se realizan pruebas t de student y suma de rangos de Wilcoxon. Resultados: Entre los dos tipos de aparatología (Convencional y autoligado) no se encontró diferencias estadísticamente significativas entre los promedios (T0 Chi2= 0.07, P= 0.09; T1 Chi2= 0.54, P= 0.53; T2 Chi2= 0.08, P= 0.10). El uso de aparatología ortodóntica genera un incremento en los marcadores de cito y genotoxicidad como micronúcleos y células binucleadas y una reducción de cariólisis y picnosis de T0 a T1, mientras que de T1 a T2 se observa una disminución en todos los marcadores, no obstante, es estadísticamente significativo para cariólisis y cariorrexis únicamente. Conclusión: Los resultados del este estudio permiten concluir que los aparatos de ortodoncia fijos inducen un aumento de la frecuencia de los biomarcadores de cito y genotoxicidad especialmente en las primeras semanas de tratamiento, sin embargo, estos efectos tienden a acercarse a los niveles iniciales en un período posterior, de esta manera se considera un daño reversible.
Palabras clave: Ortodoncia gemelar, ortodoncia de autoligado, genotoxicidad, citotoxicidad, Test de micronúcleos, células epiteliales.
Objetivo: To evaluate the genotoxic and cytotoxic damage, associated with the presence of fixed twin and self-ligating orthodontic appliances, in patients treated at the orthodontic clinic of the Universidad Cooperativa de Colombia Campus Pasto. Materials and methods: An observational, descriptive, longitudinal, temporally prospective study was carried out. A smear was performed on 30 patients, between the ages of 18 and 40, who attended the orthodontic clinic of the Universidad Cooperativa de Colombia - Campus Pasto, prior to the cementation of fixed orthodontic appliances, both twin and self-ligating, a new take at 7 days and another at 3 months. Student's t tests and Wilcoxon sum of ranks were performed according to the normality tests. Results: The use of orthodontic appliances generates an increase in cytotoxicity and genotoxicity markers such as micronuclei and binucleated cells and a reduction in caryolysis and pyknosis from T0 to T1, while from T1 to T2 a decrease is observed in all markers, not However, it is statistically significant for karyolysis and karyorrhexis only. Conclusion: The results of this study allow us to conclude that fixed orthodontic appliances induce an increase in the frequency of cyto and genotoxicity biomarkers, especially in the first weeks of treatment; however, these effects tend to approach initial levels over a period of time. later period, in this way it is considered a reversible damage.
Key words: Twin orthodontics, self-ligating orthodontics, genotoxicity, cytotoxicity, micronucleus test, epithelial cells.
Dentro de los diferentes aditamentos que se emplean en la aparatología de ortodoncia fija están arcos, brackets, tubos, bandas, resortes, ligaduras metálicas, entre otros, elaborados con diversas aleaciones metálicas, las cuales, por el tiempo promedio de uso de la aparatología, interactúan con los tejidos orales entre ellos encía y mucosa oral (1). De los constituyentes químicos de las aleaciones dentales, el uso de níquel es muy amplio y variado en aditamentos de ortodoncia, que va desde brackets y bandas hasta tubos y arcos, siendo en algunos casos utilizado durante todo el tratamiento ortodóncico y las numerosas técnicas ofrecidas al paciente (2).
Las aleaciones metálicas que componen la aparatología ortodóncica pueden permanecer en la boca durante varios años, cuya interacción con el medio oral ha sido objeto de múltiples debates. El medio ambiente bucal debido a sus características enzimáticas, térmicas, microbiológicas y químicas puede generar la degradación de los metales de los cuales están compuestos los dispositivos ortodóncicos como consecuencia de reacciones químicas (3).
La corrosión de los aparatos ortodóncicos se describe como la liberación de componentes metálicos, incluidos: Ni, Cr, Fr, Co, Cd, Cu y Mn, estos permanecen en cavidad oral, generando un ambiente potencialmente corrosivo, y que, a pesar de su alta resistencia a la misma, liberan iones metálicos en los tejidos y fluidos de los pacientes que los usan, siendo también las células epiteliales las primeras en afectarse. Los efectos colaterales en las mismas son observables en una citología exfoliativa de la mucosa oral donde se ha mostrado bioacumulación de metales, con daño concomitante en el ADN o la inhibición de su reparación que también puede contribuir a las mutaciones inducidas por los metales y la reducción de la viabilidad celular (4).
Se ha reconocido que las aleaciones de uso ortodóntico como Ni, Cr y Co, pueden producir reacciones de hipersensibilidad, toxicidad, alergia, mutagenicidad y efectos cancerígenos (2). La toxicidad de los metales se rige por múltiples factores, lo que dificulta evaluar realmente los niveles que producen daño celular.
Estudios como el de Martín – Camián y cols (2015), reafirman que la aparatología ortodóncica puede generar efectos tóxicos no solo en células de cavidad oral, sino también en las células sanguíneas y neuronales, además que es necesario evaluar la seguridad por cada caso teniendo en cuenta la variabilidad creciente de los materiales, su composición y los procesos de fabricación; concluyen que los estudios de toxicidad in vivo con respecto a la liberación de metales, la citotoxicidad y la genotoxicidad son aún escasos (5).
En igual sentido Westphalen y cols (2008), afirman que se necesitan estudios de monitoreo in vitro e in vivo para establecer relaciones de causa-efecto entre la liberación de iones metálicos y los biomarcadores de citotoxicidad y genotoxicidad y es necesario realizar más investigaciones para dilucidar los mecanismos tóxicos involucrados en los efectos observados con un énfasis especial en el daño oxidativo (6).
En relación a lo anterior , Heravi y cols (2013), destacaron que no se conoce el daño celular provocado por la ortodoncia convencional y de autoligado, sobre todo si consideramos que la última tiene diferente composición química dependiendo de la casa comercial ; elementos en la base del bracket como hierro, cromo ,carbono y en el clip Níquel y Titanio, los cuales interactúan con el pH oral, e inciden de manera diferente en el ADN contenido en las células de los tejidos orales, como producto de su proceso oxidativo (7,8).
La genotoxicidad y citotoxicidad son el resultado de un conjunto de interacciones entre el individuo y los agentes tóxicos presentes en el ambiente a los cuales está expuesto; un ejemplo de esto es el estudio de Thomas y cols (2009), quienes evaluaron indicadores genotóxicos por medio del ensayo de micronúcleos (MN) y ensayo cometa, encontrando que el daño en el ADN se incrementó tan solo 10 días después de la colocación de la aparatología ortodóncica; encontrando un aumento significativo de la frecuencia de micronúcleos 30 días después del inicio del tratamiento (9).
Se puede realizar una evaluación del riesgo de genotoxicidad en las células epiteliales bucales con algunos criterios de valoración establecidos, como el ensayo de micronúcleos (MN), el cual se ha convertido en una de las herramientas más utilizadas para evaluar daño al ADN (10). Esta prueba ha sido muy importante para monitorear eventos tóxicos causados por exposición a la aparatología fija que se usa en el tratamiento ortodóncico, debido a que las células de este epitelio de revestimiento presentan abundante citoplasma y conservan el núcleo al momento de ser exfoliadas, son de fácil acceso y es posible colectarlas mediante técnicas atraumáticas y relativamente indoloras, no necesitan ser cultivadas, la técnica es rápida, simple, económica y las muestras son fáciles de obtener (11).
Si bien, no se puede evitar el contacto con estas sustancias, los biomateriales de uso ortodóntico pueden generar un menor impacto en el daño tisular justificado en que el especialista es el encargado de elegir los materiales para intervenir a su paciente, por ende la presente investigación se constituye en un recurso para facilitar la elección de estos dispositivos para cada caso en particular considerando el daño que pueden generar en el ADN sin desligarse de la calidad y el precio en el mercado, sumado a lo anterior el profesional fundamentado en su conocimiento podrá guiar al paciente en la selección de estos materiales.
Adicionalmente, son escasos los estudios de genotoxicidad y citotoxicidad que permiten conocer en primer lugar, si existen las consecuencias de la interacción de las aleaciones que componen los brackets, arcos y otros elementos con el medio oral; y en segundo lugar el nivel de incidencia de cada uno de ellos. Por lo cual el objetivo de este estudio fue evaluar el daño genotóxico y citotóxico, asociado a la presencia de aparatología ortodóncica fija gemelar y de autoligado, en células epiteliales exfoliadas de pacientes sometidos a tratamiento de ortodoncia.
El diseño del estudio es observacional, descriptivo, longitudinal, de temporalidad prospectiva; la población fueron los pacientes que acudieron a la clínica de ortodoncia de la Universidad Cooperativa de Colombia campus Pasto, para la cementación de aparatología ortodóncica fija tanto gemelar como de autoligado, mayores de 18 años.
El número de pacientes potenciales considerados para el cálculo del tamaño de muestra inicialmente fue de 117. No obstante, debido a las medidas de contingencia sanitaria mundial por COVID-19, se replanteo el tamaño a una muestra por conveniencia de 30 sujetos para este estudio.
Los pacientes se seleccionaron bajo los siguientes criterios de exclusión: Sujetos con enfermedad crónica (diabetes, anemia, cáncer, periodontitis), pacientes que ingieran alcohol más de 4 veces a la semana, pacientes fumadores, enfermedades autoinmunes con manifestaciones en cavidad oral (lupus, liquen plano, eritema multiforme, pénfigo, penfigoide, síndrome de Sjogren), contacto constante con sustancias químicas toxicas, presentar irradiaciones en las tres últimas semanas, quimioterapia, radioterapia, estar en tratamiento de ortodoncia activo.
La recolección de las muestras se efectuó en la Clínica de Postgrado de la Universidad Cooperativa de Colombia, a los sujetos que iniciaron el tratamiento de ortodoncia; la participación en el presente trabajo de investigación fué en forma totalmente voluntaria, los sujetos se escogieron mediante la aplicación de una corta encuesta que permitió aplicar los criterios de inclusión y exclusión, con previa autorización del comité de ética institucional, quien emite el concepto bioético No. BIO72.
Hubo dos grupos de comparación, el primer grupo conformado por pacientes con tratamiento de ortodoncia con brackets de autoligado y el segundo grupo integrado por pacientes con tratamiento de ortodoncia con brackets gemelares.
Consecuentemente se llevó a cabo la toma de la primera muestra de células exfoliadas antes de iniciar el tratamiento de ortodoncia, para ello se hizo enjuagar vigorosamente la cavidad oral con un antiséptico bucal sin alcohol, luego de la mucosa interna de las mejillas y de la mucosa labial con cepillos interproximales de ortodoncia, se realizó un raspado. Se depositaron las células exfoliadas en tubos de ensayo marca Vacutainer tapa roja estéril que contenían 3 ml de cloruro de sodio al 0.09%, hasta observar turbia la solución.
Los dos tubos de ensayo que se sacaron por paciente se depositaron en una hielera aproximadamente a 10°C e inmediatamente fueron transportados al laboratorio de biología molecular de la Universidad Cooperativa donde se almacenaron en nevera a 4°C. Se llevaron los tubos de ensayo a la centrífuga por 16 minutos a 1400 revoluciones por minuto. Con una pipeta se re suspendió el pélet, se procede a completar los 3 ml de cloruro de sodio al 0.09%. Este procedimiento se repite 3 veces más para lavar completamente las células.
Luego se procede a desechar el sobrenadante y con una pipeta se resuspendió el pélet nuevamente, se adiciona la solución fijadora (Carnoy= metanol + ácido acético en una proporción 3:1) hasta completar 3 ml para llevar nuevamente los tubos de ensayo a la centrifuga por 16 minutos a 1400 revoluciones por minuto. Pasado este tiempo, se retiró el sobrenadante y se resuspendió nuevamente, luego se adicionó solución fijadora (calculando el goteo de las placas) por 20 minutos.
Después de este tiempo se resuspendió con una pipeta para después proceder a hacer el goteo de las placas las cuales se dejan secar al aire libre. Para realizar la tinción se fijaron las células, sumergiendo las placas en metanol por 10 minutos y se dejaron secar a temperatura ambiente. Posteriormente se procedió a realizar la tinción con Giemsa al 5% por 20 minutos. Luego de este tiempo, se flameó las placas rápidamente con mechero. Se procede a observar en un microscopio óptico la presencia de células binucleadas, broken eggs, micronúcleos, células con picnosis, cariólisis y cariorrexis, en cada una de las placas observadas. El análisis microscópico, lo realizó un mismo investigador observando un mínimo de 1000 células consecutivas por paciente para medir la frecuencia de los problemas genotóxicos en las células epiteliales orales.
A los 7 días de haber cementado la aparatología fija ortodóncica se procedió nuevamente a recolectar muestras de células epiteliales orales para observar la frecuencia de células binucleadas, broken eggs, micronúcleos, células con picnosis, cariólisis y cariorrexis en los individuos participantes en el estudio. El mismo protocolo de recolección de muestras se repitió a los tres meses de haber iniciado el tratamiento de ortodoncia.
El análisis estadístico se hizo con el programa SPSS IBM® Versión 25.0.
En este estudio se tomaron muestras de 30 pacientes que iniciaron tratamiento ortodóntico en la clínica de ortodoncia de la de la Universidad Cooperativa de Colombia- Campus Pasto. Ese mismo número de pacientes cumplieron con el seguimiento propuesto dado los controles de ortodoncia.
El promedio de edad de los 30 pacientes incluidos en el estudio fue 27.66 años (DE ± 8.11), con una mediana de 28 años (RI= 23-34). En su mayoría eran mujeres n=23 (76.67%), En cuanto al estrato socioeconómico, la mayoría pertenecía al estrato 2 N=20 (66.67%), seguido del estrato 3 n=9 (30%) y solo 1 individuo pertenecía al estrato 1. Estos datos se muestran en la Tabla No.1.
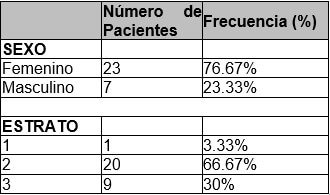
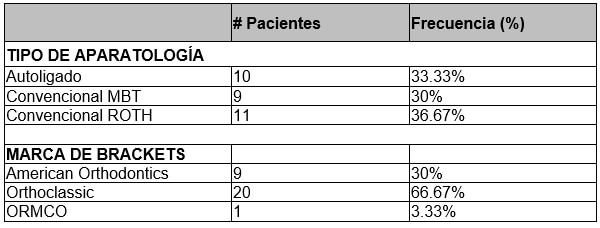
En cuanto al tipo de aparatología, el 66.67% de los pacientes (n=20) fueron tratados con ortodoncia convencional, mientras que el 33.33% (n=10) fueron tratados con autoligado. En cuanto al tipo de técnica de ortodoncia convencional 9 fueron trabajados con MBT (30%) y 11 con ROTH (36.67%). Por marca, 20 pacientes fueron tratados con Orthoclassic® (66.67%), 9 con American Orthodontics® (30%) y uno con ORMCO (3.33%). Tal y como se puede observar en la Tabla No.2.
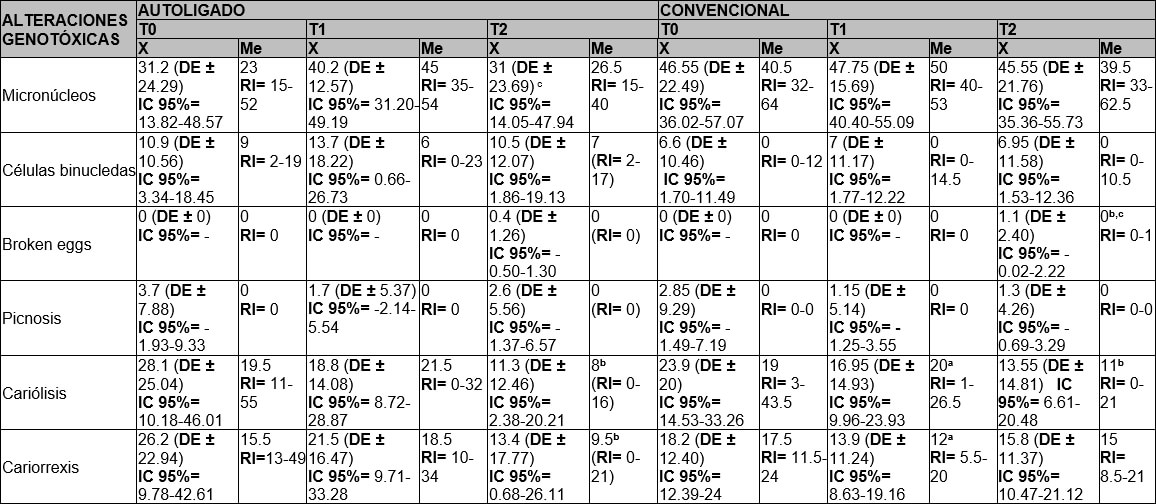
Micronúcleos: En términos generales sin considerar el tipo de aparatología, al comparar las diversas alteraciones genotóxicas se observa que, en el T0, el promedio de micronúcleos fue 41.43, en T1 se incrementa a 46.56 y en T2 se reduce a 40.7. Se ejecuta una prueba t-student pareada para determinar diferencias estadísticamente significativas entre los promedios de micronúcleos en los tiempos evaluados, sin evidenciar las mismas (T0 Vs T1 T= -1.50, P= 0.14; T1 Vs T2 T= 0.40, P= 0.68; T0 Vs T2 T= 1.83, P= 0.07).
Células binucleadas: La mediana general en T0 fue 2, disminuye en T1 siendo 0 y en T2 vuelve a ser 2, el resultado de la prueba de suma de rangos arroja que no hay diferencias estadísticamente significativas entre los tiempos. (T0 Vs T1 Z=0.40; P=0.68; T1 Vs T2 Z= -0.08; P= 0.93; T0 Vs T2 Z= -0.03, P= 0.97).
Broken eggs: Su mediana en los tres tiempos sin distinción de aparatología fue 0, a pesar de que en T2 si se encontraron observaciones. Se observaron diferencias estadísticamente significativas entre T1 y T2 adicionalmente entre T0 y T2 (T0 Vs T1 Z= -, P= 1.00; T1 Vs T2 Z= -2.44; P= 0.01; T0 Vs T2 Z=-2.44; P= 0.01).
Picnosis: En términos generales su comportamiento fue muy similar a broken eggs, dado que las medianas fueron 0 en todos los tiempos. Aunque si hubo observaciones, no se presentaron diferencias de relevancia estadística (T0 Vs T1 Z= 1.05, P= 0.29; T1 Vs T2 Z= -0.75; P= 0.44; T0 Vs T2 Z= 0.93; P= 0.35).
Cariólisis: Considerando la mediana general, esta fue 19 en T0, aumenta a 20 en T1 y reduce a 9.5 en T2. Se hallaron diferencias estadísticamente significativas entre los tiempos T0 y T1 y T0 y T2 (T0 Vs T1 Z= 2.90, P=0.00; T1 Vs T2 Z= 1.91, P= 0.05; T0 Vs T2 Z= 4.30, P= 0.00).
Cariorrexis: Finalmente, para cariorrexis la mediana es inicialmente 17.5, desciende a 12 y permanece estable en T1 y T2 (T0 Vs T1 Z= 2.71, P= 0.00; T1 Vs T2 Z= 0.80, P=0.42; T0 Vs T2 Z= 2.91, P= 0.00), encontrando diferencias de relevancia estadística de T0 con T1 y T2.
En la Tabla No. 3 se detallan estos resultados.
El promedio de micronúcleos en T0 fue 46.55, en T1 se incrementa a 47.75 y en T2 se reduce a 45.55. Dados los resultados de la prueba t-student pareada no se hallaron diferencias estadísticamente significativas entre los dos tipos de prescripción.
Por otra parte, la mediana en todos los tiempos para células binucleadas fue 0, a pesar de que, si tuvieron observaciones, puesto que su media en T0 fue 6.6, en T1 aumenta 7 y se reduce mínimamente a 6.95 en T2.
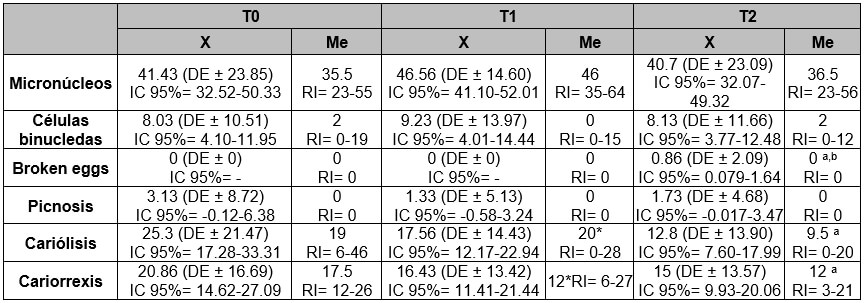
X= Media, Me= Mediana, DE= Desviación estándar * Diferencias estadísticamente significativas entre T0 y T1 a un nivel del 95% (p0.05). Prueba t-student pareada y test de Wilcoxon. a Diferencias estadísticamente significativas entre T0 y T2 a un nivel del 95% (p0.05). Prueba t-student pareada y test de Wilcoxon. b Diferencias estadísticamente significativas entre T1 y T2 a un nivel del 95% (p0.05). Prueba t-student pareada y test de Wilcoxon.
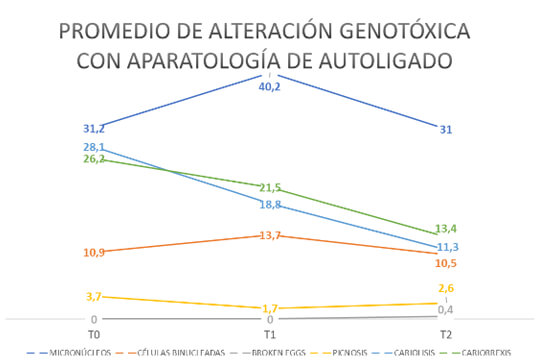
El promedio de micronúcleos fue de 31.2 en T0, 40.2 en T1 y se reduce a casi el inicial siendo 31 en T2, sin presentar diferencias estadísticamente significativas entre las medias.
Para células binucleadas, la mediana fue 9 en T0, disminuye a 6 en T1 y llega a 7 en T2.
Para broken eggs y picnosis, la mediana fue la misma en los 3 tiempos siendo esta 0. Aunque los broken eggs solo tuvieron observaciones en T2, justificado en que su media fue 0.4 y en picnosis la media fue 3.7, se reduce a 1.7 y aumenta a 2.6 para T0, T1 y T2 respectivamente.
Sobre cariólisis se puede afirmar que, la mediana fue 19.5 en T0, se incrementa a 21.5 en T1 y disminuye a 8 en T2, mientras que para cariorexis es de 15.5 en T0, 18.5 en T1 y 9.5 en T2 siguiendo el mismo patrón.
Tomando en consideración los resultados del test de Wilcoxon, se evidenciaron diferencias estadísticamente significativas entre las medianas de cariólisis y cariorrexis únicamente para la comparación entre T0 y T2.
Para determinar si había diferencias estadísticamente significativas entre los dos tipos de aparatologia (Convencional y autoligado) se ejecutó una prueba t-student con micronucleos por ser paramétrica y U Mann-Whitney con las variables restantes justificado en que no son de la misma naturaleza. Empero no se hallaron diferencias estadísticamente significativas entre las mismas (p<0.05). Lo anterior se puede observar en la Tabla No. 4 y en la figura No. 2.
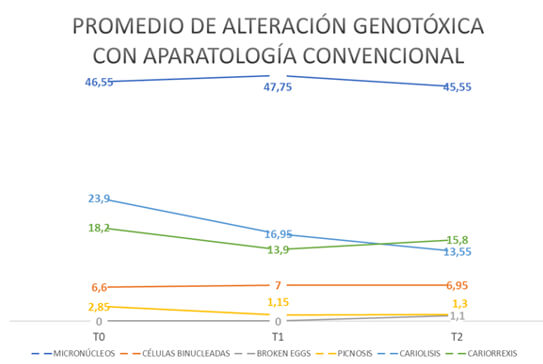
* Diferencias estadísticamente significativas entre los tipos de aparatología. pruebas t-student y U-Mann Whitney.
El tratamiento de las maloclusiones representa un problema de salud bucodental, cuya terapéutica consiste en la colocación de aparatología ortodóncica fija, la cual está constituida por diferentes aditamentos como bandas, brackets, alambres, tubos, resortes, etc.; estos están diseñados con aleaciones que contienen níquel, titanio, molibdeno, cobalto, cromo y acero inoxidable en diferentes porcentajes (12,13). En los pacientes que se someten a tratamientos de ortodoncia prolongados cuya duración fluctúa entre los 2 y 3 años, se ha demostrado riesgos a la salud provocados por la liberación de iones metálicos y producto de la corrosión del aparato ortodóncico utilizado, dado que los materiales no son estables ante un medio agresivo como la cavidad oral. En esta los efectos adversos que pueden presentarse son: glositis, gingivitis, hiperplasia gingival, dermatitis por contacto, hipersensibilidad, sabor metálico y reacciones alérgicas, que aún no están bien determinadas (14,15).
En investigaciones recientes se evidencia que el uso de la aparatología ortodóncica fija induce daño al ácido desoxirribonucleico (ADN) en las células de la mucosa oral (16,17,18,19). A lo anteriormente mencionado, se suman los materiales que se emplean para la cementación de la aparatología ortodóncica como los grabadores ácidos al 37% y los adhesivos utilizados, así como el tiempo de aplicación y concentración de los mismos, que pueden irritar los tejidos blandos de cavidad oral y además producir formación de vacuolas, daño nuclear en las células, incluyendo cariólisis y cariorrexis (20,21).
Las aleaciones metálicas también interactúan de forma sinérgica o antagónica haciendo variar el grado de daño genotóxico, el cual puede ser reparado dependiendo sí la agresión es leve o moderada; en caso contrario se induce un mecanismo de muerte celular controlado donde se manifiestan las alteraciones nucleares (22,18). Los resultados de nuestro estudio indican que existe una correlación negativa entre micronúcleos y cariólisis en T0 y T2, además de células binucleadas con picnosis y cariorrexis en T0, las células cariolíticas están completamente ausentes de ADN, razón por la cual no tienen núcleo y es probable que representen una fase muy avanzada de la muerte celular en proceso de exfoliación , así mismo la presencia de micronúcleos se puede incrementar de forma espontánea o por factores endógenos y exógenos (18); así mismo el promedio general presentó cambios significativos para broken eggs, cariólisis y cariorrexis, los cuales se hicieron extensivos al tipo de aparatología en diferentes momentos del estudio. Acorde con las investigaciones de Castro y cols, 2004, el promedio normal de las frecuencias de micronúcleos varia de una población a otra de 0.03% a 0.47%, dependiendo de factores genéticos y ambientales como alimentación, edad, sexo, etc. (23). Así mismo Fenech y cols., demostraron que las variables sociodemográficas ejercen una marcada influencia sobre la incidencia de micronúcleos en células del epitelio bucal (24), como sexo y la edad, hay múltiples estudios sobre la relación entre el cromosoma X, edad y la incidencia de micronúcleos ya que es de amplio conocimiento que hay una mayor presencia de alteraciones genéticas en mujeres que en hombres (25), lo que se ha reportado también en estudios como el de Natarajan y cols, en 2011 y de Francis y cols (26,27).
Es importante resaltar que algunos productos de uso cotidiano a los que se expone un individuo que son aplicados de forma tópica o que tienen contacto con la mucosa del tracto digestivo y respiratorio podrían tener efectos mutagénica (28). A lo anterior, se le suma otros factores exógenos como la exposición a genotoxinas ambientales u ocupacionales y estilos de vida poco saludables, como la malnutrición, que contribuyen a la presencia de alteraciones genotóxicas previas a la cementación de la aparatología como micronúcleos, células binucleadas, picnosis, y cariorrexis (24), ver figura No.3. Esto puede variar de acuerdo con la susceptibilidad propia del individuo, lo cual justifica el conteo de alteraciones celulares desde el T0 (29,9,10).
La evidencia respecto al tiempo de exposición de la aparatología de ortodoncia indica que el daño celular comienza a partir de la primera semana de cementación, pero puede disminuir de acuerdo con el tiempo de exposición (6). Según Camean y cols (2015) , Francis y cols (2017) a los 7 días de la cementación de la aparatología de ortodoncia hubo un aumento de micronúcleos debido a que hay una liberación máxima de metales en la etapa inicial del tratamiento, sin embargo, esta tasa probablemente disminuye con el tiempo por la capacidad de reparación de las células epiteliales, ya que los tiempos de renovación del epitelio bucal humano tienen un valor medio de 7 a 14 días (30), razón por la cual los micronúcleos presentes en células exfoliadas del tejido epitelial se forman en las células de la capa basal, que es donde se da el proceso de división celular, estas migran a la superficie nuevamente en un transcurso de 5 a 14 días (18), lo anterior se corrobora con nuestro estudio ya que en T1 correspondiente a 7 días posteriores a la cementación, la mediana aumenta para micronúcleos, cariólisis y cariorrexis, volviendo en T2 a los valores aproximados a los iniciales (T0).
Cabe resaltar que los diferentes tiempos de nuestro estudio mostraron una variación en las alteraciones genotóxicas más prevalentes como son micronúcleos y células binucleadas. Desde T0 los pacientes ya presentaban anomalías nucleares, siendo producto de su interacción con el medio ambiente, en T1 aumentaron y posteriormente disminuyeron en T2, a pesar de que no se comportó así en todas las alteraciones sobre todo en la aparatología de autoligado. El marcador más difícil de encontrar fue broken eggs.
Además, una diferencia estadísticamente significativa en cariólisis y cariorrexis en los diferentes tiempos con aparatología convencional, lo que se podría atribuir a la mayor cantidad de aditamentos que se emplean como elasties, cadenetas, ligadura metálica, entre otros. El comportamiento inusual de estos marcadores radica en que era de esperarse un aumento en T1 o T2 dada la continuidad de la exposición o un aumento en T1 y reducción en T2 buscando normalizarse; lo que se evidenció en nuestro estudio que mostró un aumento en T1 y disminución en T2 (27). Thomas y cols., en 2011 en su investigación evaluaron otras variables como la nutrición, sugiriendo que los suplementos de vitaminas antioxidantes y ciertos componentes del complejo B pueden causar una reducción sustancial de la frecuencia de micronúcleos (31).
No obstante otros estudios han evaluado la descarga de iones metálicos de aparatos de ortodoncia en fluidos biológicos, y la mayoría ha concluido que no alcanzan concentraciones tóxicas, como lo mencionado por Heravi y cols, en 2013 donde afirman que no se encontraron diferencias significativas en el recuento de micronúcleos, lo que indica que la colocación de aparatos de ortodoncia fijos no aumenta el riesgo de daño genotóxico en el epitelio oral (7), lo cual podría ser aclarado con lo reportado por Eliades y Athanasios, en 2002 ,quienes encontraron que durante el ataque microbiano a la aparatología ortodóncica se generan diversos ácidos en el medio intraoral, así mismo en la superficie de los dientes se crea un biofilm con la ayuda de restos alimenticios y productos del metabolismo microbiano, el cual se forma de cloruro sódico, cloruro potásico y fosfato cálcico cristalino que, posteriormente, se precipitan sobre el sustrato de la aleación, proporcionando una película interna protectora, reduciendo de este modo la incidencia de la respuesta inmune del huésped ya que aminora la exposición de la superficie de la aleación al ambiente oral. Esta formación del biofilm proporciona la denominada “Resistencia a la Corrosión” (32), lo cual puede estar ligado a la reducción de algunos marcadores en T2.
Con relación a las células binucleadas se puede inferir que su comportamiento difiere al de los micronúcleos, las cuales no se presentaron en T1, pero si están presentes en T0 y T2 en igual promedio, sin encontrarse evidencia científica que explique su comportamiento. Finalmente, en concordancia con el estudio de Francis y cols., en 2017 (27), esta investigación sugiere que el tratamiento de ortodoncia logró inducir alteraciones celulares posiblemente a la liberación de iones de los materiales empleados durante el tratamiento tanto de autoligado como gemelar, sin embargo, estas alteraciones no se pueden considerar malignas debido a que son reversibles.
Se sugiere en futuros estudios hacer un seguimiento más prolongado para observar variaciones en las alteraciones genotóxicas, así como también evaluar la presencia de las mismas además de citotóxicas generadas por la exposición a un factor externo (Corrosión), a través diferentes pruebas o ensayos in vitro como el Test de Ames, el ensayo cometa y la liberación iónica en pelo del cuero cabelludo, con el fin de determinar la biocompatibilidad de los materiales dentales y la repercusión que se pueda ocasionar en la salud de los pacientes con tratamientos de ortodoncia, de igual manera hacer un seguimiento más prolongado. Estas pruebas de citotoxicidad y genotoxicidad pueden ser aplicadas a las nuevas tendencias de ortodoncia invisible.